
Resumen
El proyecto Finisterrae trata de la búsqueda de soluciones efectivas para las enfermedades raras, neurodegenerativas y cáncer, a partir del estudio del big data biomédico procedente de datos genéticos y de tipo hospitalario. A partir de técnicas de aprendizaje automático, optimización, de identificación de parámetros, de reducción de la dimensión y selección de atributos y de análisis de incertidumbre somos capaces de diseñar robots biomédicos que en un solo paso son capaces de ir desde los datos genéticos hasta la búsqueda de medicamentos huérfanos o el reposicionamiento de los mismos. Asimismo, esta metodología permite el diseño de sistemas de ayuda a la decisión en el ámbito hospitalario mediante la fusión de diferentes tipos de datos.
Juan Luis Fernández-Martínez
Grupo de Problemas Inversos, Optimización y Aprendizaje Automático, Departamento de Matemáticas, área de Matemática Aplicada de la Universidad de Oviedo
Juan Luis Fernández-Martínez es Doctor Ingeniero de Minas (Oviedo, 1994) y director del Grupo de Problemas Inversos. Previamente estudió Ingeniería de Minas en la Escuela de Minas de Oviedo (Oviedo, 1986) e Ingeniería del Petróleo en Francia (Instituto Francés del Petróleo, Paris, 1988) e Inglaterra (Imperial College of Science and Technology, Londres 1989). Durante 2008-2010 fue profesor de investigación en las Universidades de California-Berkeley, Universidad de Stanford y Lawrence-Berkeley Laboratories. Sus líneas de investigación incluyen los problemas inversos, el análisis de incertidumbre de sistemas complejos, las técnicas de reducción de la dimensión y de selección de atributos, los algoritmos bioinspirados de optimización global, las técnicas de aprendizaje e inteligencia artificial, la biometría y la biomedicina. En el área de la biomedicina Fernández-Martínez está interesado en el diseño de robots biomédicos y de sistemas inteligentes en medicina traslacional, para el diagnóstico, prognosis y optimización del tratamiento de diferentes cánceres, enfermedades raras y neurodegenerativas.
Enrique J. deAndrés-Galiana
Grupo de Problemas Inversos, Optimización y Aprendizaje Automático, Departamento de Matemáticas, área de Matemática Aplicada de la Universidad de Oviedo
Enrique J. de Andrés-Galiana es ingeniero informático y doctor en matemáticas (Oviedo, 2016). Es miembro del Grupo de Problemas Inversos. Su tesis doctoral ha versado sobre el diseño de robots biomédicos y su aplicación en medicina traslacional.
Ana Cernea
Grupo de Problemas Inversos, Optimización y Aprendizaje Automático, Departamento de Matemáticas, área de Matemática Aplicada de la Universidad de Oviedo
Ana Cernea es matemática y doctora en matemáticas (Oviedo, 2014). Es miembro del Grupo de Problemas Inversos. Su tesis doctoral ha versado sobre la indexación automática de imágenes y técnicas de biometría.
Zulima Fernández-Muñiz
Grupo de Problemas Inversos, Optimización y Aprendizaje Automático, Departamento de Matemáticas, área de Matemática Aplicada de la Universidad de Oviedo
Zulima Fernández-Muñiz es ingeniera de minas y doctora en matemáticas (Oviedo, 2012). Es miembro del Grupo de Problemas Inversos. Su tesis doctoral ha versado sobre técnicas de reducción de la dimensión y de análisis de incertidumbre en problemas inversos.
Ignacio Fernández-Alberti
Consultor Social Media y Market Access en Salud Social Media
Ignacio Fernández-Alberti es Consultor Social Media y Market Access en SALUD SOCIAL MEDIA. Impulsor de marcas novedosas en los campos de la salud y la tecnología.
1. El Proyecto Finisterrae y las enfermedades raras y neurodegenerativas
Las enfermedades raras tomadas en conjunto afectan a una gran cantidad de personas. Se calcula que tanto en los Estados Unidos como en Europa, las 7.000 enfermedades raras que existen afectan a 30 millones de personas. En ocasiones dichas enfermedades afectan a un número reducido de personas muy dispersas geográficamente, por lo que la colaboración internacional es crucial. Estas circunstancias influyen notablemente en el desarrollo de nuevos fármacos por parte de la industria. En muchos casos su estudio ha quedado relegado a fundaciones y a grupos de investigación que con recursos muy limitados intentan avanzar en su comprensión. Pese a dichos inconvenientes, el auge de los métodos de análisis del genoma ha propiciado un avance significativo en su estudio. Fruto del uso de estas técnicas, en 2013 se aprobaron 13 nuevas drogas y terapias para patologías tales como la enfermedad de Cushing, la fibrosis quística o la enfermedad de Gaucher.
Gran parte de la investigación realizada actualmente por las compañías farmacéuticas conciernen algunos cánceres raros, desórdenes genéticos, enfermedades neurológicas y neurodegenerativas, enfermedades infecciosas y enfermedades autoinmunes. En 2013 existían alrededor de 450 nuevos medicamentos en el mercado para tratar enfermedades raras, que poseen una gran variedad y afectan al sistema nervioso, respiratorio y cardiovascular, muscular, inmunológico y metabólico. Su estudio y solución, aparte de ser una cuestión de solidaridad, también puede beneficiar al estudio de otras patologías más comunes.
Las enfermedades raras tomadas en conjunto afectan a una gran cantidad de personas. Se calcula que tanto en los Estados Unidos como en Europa, las 7.000 enfermedades raras que existen afectan a 30 millones de personas
Por otra parte, el estudio de las principales enfermedades neurodegenerativas es una clara prioridad dado que actualmente en Europa el 16% de la población es mayor de 65 años, y sólo la enfermedad de Alzheimer y trastornos relacionados afectan a más de 7 millones de europeos. Además, se espera que esta cifra se duplique cada 20 años. Sólo en España el Alzheimer afecta a 1,2 millones de personas, y la enfermedad de Parkinson a más de 150.000. Estas estadísticas son incluso más impactantes si se tiene en cuenta el aumento de la esperanza de vida en las sociedades más avanzadas y el deterioro de las condiciones medioambientales. Aunque existe una gran investigación a este respecto, los tratamientos existentes para enfermedades neurodegenerativas son muy limitados y sólo se tratan los síntomas en lugar de buscar soluciones que aborden las causas. Algunas enfermedades neurodegenerativas, como la ELA, son además catalogadas como enfermedades raras. Además, no es de descartar que los genes que están implicados en la neurodegeneración motora estén implicados en una amplia gama de enfermedades, y por lo tanto, es importante entender sus similitudes y diferencias. Creemos que el análisis retrospectivo de diferentes conjuntos de datos es útil para avanzar en el desarrollo de soluciones alternativas. En ambos casos, es necesario el diseño de herramientas bioinformáticas, que sirva para avanzar en su conocimiento y en la búsqueda de soluciones efectivas. Paralelamente, dichas metodologías también pueden ser empleadas en el estudio de diferentes cánceres.
Los principales objetivos del proyecto FINISTERRAE son:
- El diseño y mejora iterativa de una herramienta bioinformática que sirva para “afinar y centrar el tiro” en el estudio y solución de las enfermedades raras y neurodegenerativas, optimizando recursos y disminuyendo al máximo el tiempo necesario para la búsqueda efectiva de soluciones. Gran parte de esta herramienta ya ha sido desarrollada, pero su mejora debe ser continuada, incluyendo nuevos algoritmos de reducción de la complejidad, de análisis ontológico de vías genéticas, y de búsqueda de medicamentos huérfanos.
- La reinterpretación de los conjuntos de datos genéticos puestos a disposición en bases de datos públicas, con objeto de elaborar una memoria de resultados personalizada para cada enfermedad. Se creará una base de datos jerarquizada con los resultados obtenidos de modo que se pueda establecer vínculos relacionales entre diferentes patologías, vías genéticas, procesos biológicos implicados, funciones moleculares y compuestos químicos con sus correspondientes genes accionables. La búsqueda de nuevos genes accionables y de medicamentos huérfanos será uno de los principales objetivos de la investigación. Se hará especial hincapié en enfermedades de mayor prevalencia para las cuales existen datos. En el futuro se pretende crear una plataforma web asociada al proyecto FINISTERRAE donde otros equipos de investigación puedan analizar sus datos y obtener resultados de modo inmediato. De esta manera, el proyecto FINISTERRAE enriquecerá su base de conocimiento sobre diferentes tipos de enfermedades.
- El estudio de las principales enfermedades neurodegenerativas para el descubrimiento de los principales mecanismos de acción. Poseemos resultados preliminares sobre Alzheimer y las principales diferencias con el Deterioro Cognitivo Leve, sobre la enfermedad de Parkinson, la ELA y la Esclerosis Múltiple. Estas enfermedades comparten algunos mecanismos genéticos que serán estudiados, así como su relación con algunas enfermedades raras. Además es importante la búsqueda de biomarcadores para su diagnóstico precoz, y el estudio de las vías biológicas involucradas. El mismo procedimiento puede ser seguido para el estudio de diferentes tipos de cánceres, para cuyo estudio han sido destinados grandes medios de investigación, habiendo obtenido resultados decepcionantes.
- Finalmente, la medicina traslacional necesita de métodos que sirvan para la optimización de tratamientos, la minimización de efectos secundarios y la segmentación de pacientes en función de su respuesta, lo cual redundará en un aumento significativo de los medicamentos investigados que pasarán a la fase clínica.
Se trata pues de un proyecto transversal que proporcionará un avance en el conocimiento y en la búsqueda de soluciones efectivas para diferentes tipos de patologías. Las metodologías empleadas permiten la fusión de diferentes tipos de datos (genéticos, hospitalarios, etc.) para la mejora del tratamiento personalizado.
La metodología FINISTERRAE
Como ha sido anteriormente mencionado, el proyecto FINISTERRAE comporta el diseño de una metodología “de bajo coste” para el estudio de enfermedades raras/neurodegenerativas que permite la generación ultrarrápida de hipótesis de trabajo y la búsqueda de nuevas dianas terapéuticas y/o de medicamentos huérfanos.
Es posible trabajar con diferentes tipos de datos genéticos: arrays de expresión, RNA-seq, SNPs (Single Nucleotide Polymorphism), micro-RNAs, biopsias líquidas, datos epigenéticos, etc.
Los problemas biomédicos se clasifican en dos tipos: problemas de predicción y problemas de clasificación. En el primer caso se trata de problemas de regresión, es decir, de realizar la predicción de una variable continua a partir de una serie de variables predictoras, relacionadas débilmente con la variable de salida. En el segundo caso se trata de diseñar clasificadores, por ejemplo binarios, que sean capaces de separar diferentes fenotipos, por ejemplo normal vs anormal/patológico, o respuesta frente a no respuesta, desarrollo o no de efectos secundarios, etc. Ambos problemas, de predicción y de clasificación, poseen su propio espacio de incertidumbre [10, 2]. Además, en general un problema de clasificación binario suele poseer un espacio de incertidumbre más reducido que un problema de regresión. Para entender este hecho, sólo hay que pensar que es mucho más incierto predecir el valor de una variable, que su pertenencia a un intervalo. En el segundo caso la pregunta está mejor planteada, y puede ser suficientemente precisa para la toma de decisiones en la práctica clínica. Por lo tanto, siempre que sea posible es mucho más interesante y ventajoso plantear los problemas de decisión como problemas de clasificación. Es la conocida estrategia del dedo del César, pero en este caso asignándole una probabilidad de vida o muerte a su decisión.
La metodología FINISTERRAE se basa en el desarrollo del concepto de robots biomédicos [2] y su uso en el descubrimiento de información en grandes bases de datos genéticos/hospitalarios, y en la optimización de procesos, por ejemplo, el diseño de medicamentos. Un robot biomédico es el conjunto de técnicas provenientes de la matemática aplicada y las ciencias de la computación que sirven para estudiar dinámicamente grandes bases de datos genéticas, descubrir conocimiento y realizar predicciones con su incertidumbre asociada. El concepto de dinamismo es muy importante pues el grado de información depende del tiempo, con lo cual los sistemas de aprendizaje deben de ser actualizados. Por otro lado, en experimentos genéticos el número de muestras (pacientes) es siempre muy inferior al número de sondas genéticas. Se trata pues de un problema altamente indeterminado, con una gran incertidumbre. Es necesario el uso de métodos que cuantifiquen dicha incertidumbre otorgando a los genes un poder discriminador de un determinado fenotipo. El análisis bioinformático hace uso de diferentes tipos de técnicas de selección de atributos (firmas genéticas) y de reducción de la dimensión, que son robustas a diferentes tipos de ruido [3]. Este análisis proporciona el conjunto de firmas genéticas a pequeña escala con mayor poder discriminador, que serán utilizadas para el análisis ontológico de las vías genéticas implicadas y las redes de correlación entre dichos genes. También sirve para descubrir las interacciones biológicas entre los diferentes genes y proporcionar una idea precisa de los mecanismos de acción implicados en el desarrollo de dichas enfermedades. Para el análisis ontológico se utilizan entre otros el programa GeneAnalytics del Weizmann Institute of Science, que trata además de investigar los mecanismos moleculares asociados con los genes y explorar las relaciones entre los fármacos existentes en el mercado con las redes genéticas implicadas en el desarrollo de dichas enfermedades. Como resultado de estos análisis se obtienen una lista de genes y vías genéticas accionables mediante medicamentos huérfanos. En el caso de que dichas drogas no existan, la herramienta FINISTERRAE puede ser utilizada para la optimización de ensayos clínicos y el estudio y optimización de los aspectos fármaco-genéticos y fármaco-cinéticos de los fármacos que serán objeto de estudio en base a dichos análisis. Además creemos, que en contraste con otro tipo de enfermedades que suelen ser multifactoriales, las enfermedades raras y algunas neurodegenerativas suelen ser el resultado de la disfunción de un conjunto limitado de vías genéticas defectivas, por lo que es de esperar que la metodología FINISTERRAE sirva para encontrar en muchos casos una rápida solución. El análisis de dichas vías también puede propiciar un avance teórico en el conocimiento de otras enfermedades más comunes, como el cáncer.
La metodología FINISTERRAE se basa en el desarrollo del concepto de robots biomédicos y su uso en el descubrimiento de información en grandes bases de datos genéticos/hospitalarios, y en la optimización de procesos, por ejemplo, el diseño de medicamentos
En el caso de los problemas de predicción de fenotipos a partir de datos genéticos, la metodología FINISTERRAE primero ordena los genes con respecto a su poder discriminador, que se define a partir de diferentes conceptos relacionados con la información de clase [3], y mediante clasificadores sencillos del tipo vecino próximo, se establece la firma genética a pequeña escala con mayor poder discriminador y mayor robustez, es decir, que sea lo más estable posible a la falta parcial de información, o lo que es equivalente, a la incorporación de nuevos datos. Se utilizan para ello técnicas de optimización global tipo PSO [11], técnicas de muestreo y de análisis de incertidumbre en problemas de identificación de parámetros [7]. El resultado de este análisis es el conjunto de firmas y vías genéticas que poseen un poder predictor similar, medido a través de experimentos de validación cruzada [16] o de validación a ciegas. Asimismo, utilizando paquetes informáticos de ontología de genes, este análisis proporciona los procesos biológicos y moleculares implicados, las principales enfermedades y fenotipos que comparten ciertas similitudes en los mecanismos de acción, así como la existencia de compuestos y fármacos, y los genes que éstos accionan. En este estudio es importante tener en cuenta el efecto de las técnicas de pre-procesado de los microarrays en el estudio de las vías genéticas implicadas. Hemos mostrado que el estudio con datos brutos es mucho más fiable, y hemos desarrollado algoritmos de selección de genes discriminadores en este caso [4].
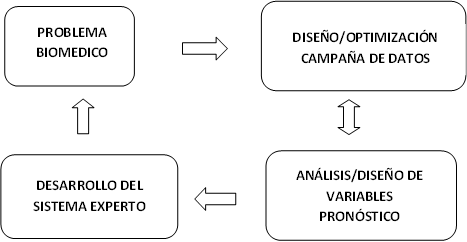
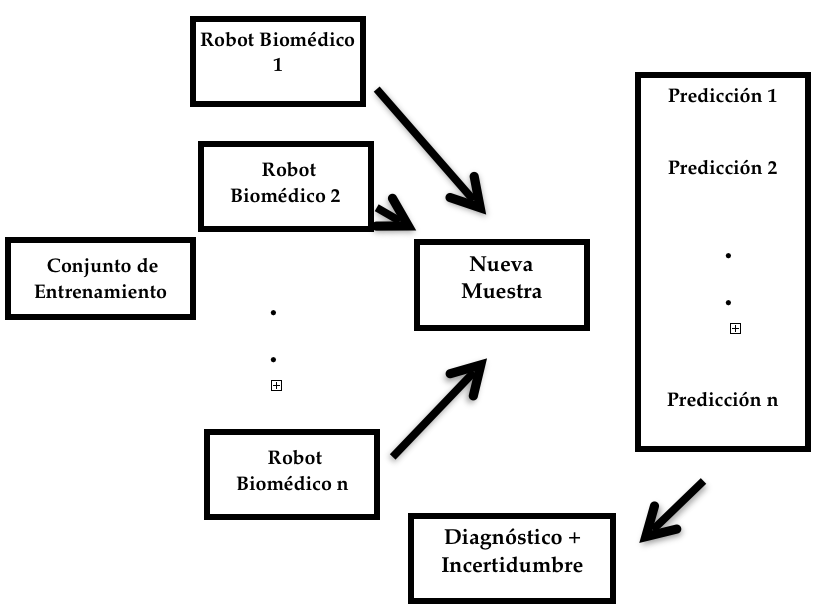
La figura 1 muestra el diagrama de flujo seguido en la resolución de un problema biomédico. En particular el diseño y optimización de la campaña de toma de datos es una etapa fundamental en el éxito del proceso. Una vez que las muestras han sido recogidas se procede a la asignación de clases por parte de los expertos médicos. Esta etapa debe de ser realizada con sumo cuidado dado que errores en la catalogación de las muestras aumentan la complejidad del modelo predictivo, degradando al mismo tiempo su capacidad de generalización, es decir, la correcta predicción de muestras no observadas. La metodología Finisterrae trata de evitar la creación de modelos de predicción de tipo caja negra, dado que cuando en un problema de predicción se determinan las variables predictoras, en caso de existir, el problema de predicción (o de clasificación en este caso) se simplifica notablemente. La figura 2 muestra el esquema conceptual de un robot biomédico [1]. Para ello, es necesario construir el predictor/clasificador teniendo en cuenta las variables pronóstico y muestrear el espacio de incertidumbre del mismo, es decir, encontrar diferentes combinaciones de bases predictoras con igual poder discriminador. Una vez que se obtienen dichas bases, la predicción final se puede realizar por consenso, como podría actuar un equipo médico.
Esta metodología ha sido probada con éxito en el estudio de diferentes patologías, como por ejemplo la predicción del grado de fatiga crónica severa en enfermos con cáncer de próstata sometidos a radioterapia [14, 13], mostrando las bases genéticas que modelan este efecto secundario; la integración genómica de las principales mutaciones en enfermos con Leucemia Linfocítica Crónica, explicando cómo éstas impactan al transcriptoma, y mostrando su efecto sobre los mecanismos de señalización de la interleucina-4, que interviene en procesos de regulación del sistema inmunitario [12]. También se estudió el efecto de la gastrokina-1 (AMP-18) en cánceres de cabeza y cuello caracterizando los mecanismos de acción en dicho tipo de cánceres a partir de un número limitado de muestras [15].
En el caso de las enfermedades raras hemos utilizado como prueba de concepto, también hemos estudiado la esclerosis sistémica, enfermedad para la cual Genentech ha desarrollado Tocilizumab, un anticuerpo monoclonal que se une al receptor celular de la interleucina-6 y que posee un papel importante en la respuesta inmunitaria. Un resultado interesante de nuestro análisis reveló la importancia de la interleucina-32, que es una citoquina pro-inflamatoria que induce a las células del sistema inmunológico (como monocitos y macrófagos) a segregar citoquinas inflamatorias, como el factor de necrosis tumoral TNF-alfa y la interleucina-6. Asimismo, Celgene ha desarrollado recientemente Pomalyst (pomalidomida). La pomalidomida es una droga anti-angiogénica que actúa como inmunomodulador provocando la sobreregulación de IL-2/IL-10 y la subregulación de IL-6. Como ha sido reflejado con anterioridad la producción de Il-6 está relacionada con IL-32. La metodología FINISTERRAE reveló varias vías genéticas relacionadas con las interleucinas.
También FINISTERRAE ha sido utilizada en el estudio de la Miositis-Polimiositis y de la Esclerosis Lateral Amiotrófica (ELA) [2]. En el caso de la Miositis hemos mostrado la importancia de la vía interferón, de los mecanismos de respuesta inmunológica y de diferentes genes del complejo mayor de histocompatibilidad, así como la posible relación con infecciones mediante diferentes virus o bacterias. Actualmente, en colaboración con un equipo de expertos en inmunología de la Universidad de Oviedo, hemos logrado establecer las diferencias entre las vías genéticas de la miositis y la polimiositis, acotando una serie de genes desregulados que se expresan solo en el músculo y que pueden ser nuevas dianas terapéuticas. Estos últimos resultados están aún en fase de elaboración. En el caso del ELA hemos mostrado la importancia de la vía relacionada con las caspasas, que controlan el mecanismo de muerte celular programada y que en modelos animales transgénicos se han relacionado también con la mutación del gen SOD1.
En cuanto a las enfermedades neurodegenerativas hemos obtenido los siguientes resultados:
- En el caso de la Esclerosis Múltiple poseemos resultados preliminares que muestran la importancia de las vías genéticas CD28 y de Células Presentadoras de Antígeno, lo cual sugeriría un posible origen infeccioso.
- En el caso de las distrofias musculares también aparecen como principales vías genéticas el Factor de Necrosis Tumoral y el NF- kB.
- En el caso del Parkinson, las vías implicadas están relacionadas con la hipoxia (HIF-1 signaling), y con mecanismos de transcripción (FOXA1 transcription factor) y señalización (P-53 signaling).
- Finalmente, en el caso del Alzheimer y del deterioro cognitivo leve los resultados preliminares obtenidos son muy sorprendentes e implican procesos de traslación del MRNA viral.
Todos estos resultados están en fase de publicación, así como otros estudios que incumben a las bases genéticas de la fibromialgia, la optimización de tratamientos y la predicción de metástasis en cáncer de mama, el estudio de las firmas genéticas de diferentes tipos de cáncer (pulmón, próstata y páncreas) y de los mecanismos comunes de metástasis, etc.
Se trata en definitiva de mejorar el diagnóstico precoz y posibilitar la optimización de tratamiento personalizado (medicina de precisión), minimizando los efectos secundarios (toxicidades) con objeto de evitar sufrimientos innecesarios a los pacientes, valorizando los datos genéticos y los datos hospitalarios
También hemos trabajado con datos hospitalarios en el desarrollo de sistemas de ayuda a la toma de decisiones, sobre la respuesta al tratamiento para enfermos con linfoma de Hodgkin con datos hematológicos [6], y en la predicción del desarrollo de enfermedades autoinmunes y la necesidad de quimioterapia en pacientes con Leucemia Linfocítica Crónica [5], en la caracterización del grado histológico de cánceres de mama triplemente negativos [8] a partir del estudio de datos hospitalarios en colaboración con el servicio de Anatomía Patológica del HUCA (Asturias).
En definitiva, el estado del arte de la matemática aplicada y de los métodos de inteligencia artificial permiten hacer el big data biomédico pequeño (Little Big data) y diseñar sistemas de ayuda a la toma de decisiones y al descubrimiento de nuevo conocimiento para el diseño de tratamientos personalizados en cáncer, enfermedades raras y neurodegenerativas. Se trata en definitiva de mejorar el diagnóstico precoz y posibilitar la optimización de tratamiento personalizado (medicina de precisión), minimizando los efectos secundarios (toxicidades) con objeto de evitar sufrimientos innecesarios a los pacientes, valorizando los datos genéticos y los datos hospitalarios. Los pacientes desean que se empleen sus datos para curar a otros, con la adecuada seguridad por supuesto. Este debería de ser un tema superado. La supervivencia en el tiempo de nuestro sistema nacional de salud quizás depende del uso de estas metodologías.



