Resumen
Hoy la informática juega un papel muy importante en el campo de la salud, no sólo en lo que respecta a la gestión de la información, sino en la participación directa en los diseños y aplicaciones de tratamientos y soluciones para el paciente. Socinser, como ingeniería biomédica, crea y patenta mundialmente el entorno NETEOUS®, herramienta que permite colaborar al equipo médico en tiempo real desde diferentes puntos geográficos, compartiendo la información del paciente como fórmula concurrente de abordaje de esos proyectos de soluciones complejas, ahorrando tiempo y dinero, y facilitando desde la visualización, tanto 2D como 3D, de los modelos anatómicos, pasando por la planificación y generación de modelos, hasta la simulación de las soluciones propuestas, incluyendo todo el proceso de mejoras hasta el suministro de los materiales requeridos en cada caso. Exponemos el proceso de planificación y sus fases, con ejemplos. Estas herramientas han permitido dar un importante salto en el reparto de tareas de las organizaciones médicas y asistenciales, mejorar la comunicación en el entorno facultativo y, sobre todo, evolucionar los métodos quirúrgicos. Se da un cambio de paradigma hacia la personalización de soluciones, llegando a girar de una forma clara alrededor de la problemática singular de cada paciente y, en consecuencia, se ha potenciado la Cirugía Mínimamente Invasiva, logrando reducir los procesos de Recuperación postquirúrgica e incrementando la eficacia de las soluciones.

Manuel Angel González Rodríguez. Ingeniero industrial. Desde 1984 trabajando en Departamentos de I+D de algunas de las ingenierías más importantes de Asturias, proyectando nuevas líneas de negocio basadas en la innovación y el desarrollo tecnológico. Vuelca la experiencia adquirida en la creación, en 1996, de la sociedad Socinser 21, S.A., cuya actividad se centra en el desarrollo, fabricación y comercialización de productos sanitarios y cuya actividad ha sido galardonada con el Premio a la Innovación en Asturias y ha desarrollado 15 patentes propias, 5 patentes de invención, 8 marcas registradas, más de 70 proyectos de nuevos productos y diversos proyectos de ingeniería por encargo.
Carlos Cuesta Sánchez
Responsable del Departamento de Imagen Médica de Socinser 21, S.A.

Carlos Cuesta Sánchez. Ingeniero Técnico Informático. Responsable del Departamento de Imagen Médica, se dedica al desarrollo de software para el campo de la medicina desde 2004 donde comienza como investigador en la Universidad de Oviedo y su relación con Socinser 21.S.A, como empresa promotora de proyectos de I+D+I. Se ha especializado en el área gráfica de la informática, y su aplicación al desarrollo de soluciones para el tratamiento de imagen médica, sistemas de planificación quirúrgica y tratamiento virtual de estructuras anatómicas.
1. Introducción
La historia de la imagen en Medicina empezó con la Fotografía, siguió con los RX, Cine, Computadora, Tomógrafo, Ultrasonidos, Resonancia Magnética, Medicina Nuclear y otras técnicas de captación de imagen, hasta la digitalización total con la desaparición de la placa radiográfica a finales del siglo XX y principios del XXI.
Si bien es conocido el hecho significativo que supuso la primera radiografía (la mano de Berta, esposa del inventor de los RX), hoy no estaríamos hablando del Software como herramienta sin la gran aportación que supuso la aparición del TAC en 1972, dando un salto del manejo de información 2D a la información 3D, que aprovechándose de las capacidades computacionales de la época, permitían la reconstrucción tridimensional a partir de la laboriosa introducción de datos de modo manual sobre las primeras plantillas de digitalización.
El manejo de la información 3D, obtenida a partir de cortes del tejido a observar, estaba enfocada en sus inicios a poder realizar diagnósticos más certeros y más precisos, pero poco tiempo después, la industria del sector de dispositivos médicos, comienza su utilización con fines terapéuticos, aportando datos a los especialistas fruto de las mediciones que podían realizar sobre los modelos 3D virtuales y a partir de esta información ayudar al prescriptor a seleccionar la mejor solución en casos muy comprometidos.
2. Software y Medicina
Aunque aparentemente son dos disciplinas muy distintas, la informática juega un papel importante en el campo de la medicina, y no ya en lo que respecta a la gestión de la información, como sucede en tantos otros campos, sino en la participación directa en los tratamientos para el paciente, buscando mejores soluciones y más efectivas tanto en su diseño como en su aplicación.
Cuando pensamos en desarrollo de software habitualmente tenemos en mente una aplicación que se ejecuta en un PC, o más recientemente en un teléfono móvil. Pero existen multitud de dispositivos utilizados en el ámbito sanitario que dependen de una parte software para su funcionamiento, desde el más simple sistema de monitorización, hasta el más complejo robot quirúrgico, pasando por sistemas de navegación y planificación quirúrgicos. Todos ellos, ya sean más o menos complejos, tienen algo en común y es que, pese a ser un elemento software son considerados como un producto sanitario, y por lo tanto están regulados bajo la misma normativa.
La normativa aplicable al software como producto sanitario viene regulada principalmente por la ISO 13485 como marco para el sistema de gestión de calidad, la ISO 14971 como marco regulador para la gestión de riesgos, y en lo que respecta al ciclo de vida del software por la IEC 62304 y IEC 62366 para la usabilidad [3].
Hoy en día son cada vez más el número de aplicaciones o apps relacionadas con la salud, desde medidores de calorías, hasta gestores de nuestro sueño, pero esto no las convierte en un producto sanitario. Su clasificación depende de las implicaciones que tiene, o pudiera tener, para la salud de las personas (pacientes, personal sanitario, etc.) y se divide en tres tipos según la IEC 62304 [1]:
- Clase A: no es posible lesión o daño para la salud.
- Clase B: es posible una lesión no seria.
- Clase C: es posible una lesión seria o muerte.
Hoy en día son cada vez más el número de aplicaciones o apps relacionadas con la salud, desde medidores de calorías, hasta gestores de nuestro sueño, pero esto no las convierte en un producto sanitario
Desde el punto de vista del desarrollador software la principal diferencia a la hora de abordar un proyecto de este tipo consiste en la importancia que tiene la gestión de riesgos en el análisis y diseño de la solución. La norma IEC 62304 nos indica las distintas etapas que debe seguir el desarrollo del software, que serían las mismas que en un desarrollo en cascada clásico, añadiendo un proceso para la gestión de riesgos que se extendería durante todo el ciclo de vida del producto. Este proceso mantendrá un registro con los riesgos identificados y las medidas correctoras correspondientes, de forma que podamos realizar un análisis del riesgo/beneficio y presentar las conclusiones en el expediente de gestión de riesgos para la aprobación final del producto. El proceso de gestión de riesgos no termina una vez liberado el producto sanitario, se debe mantener un registro durante la fase de post-producción que ayude a detectar posibles anomalías y su gravedad.
3. En Socinser
Socinser como empresa de servicios de Ingeniería al sector Médico quirúrgico, era consciente de la enorme importancia que tenía poder disponer de una herramienta que permitiese trabajar a los diferentes miembros de un equipo en la distancia, desde diferentes puntos geográficos pero en tiempo real y compartiendo la información del paciente como fórmula concurrente de abordaje de esos proyectos de soluciones complejas.
El uso de programas comerciales CAD/CAM, tan habitual como herramientas de diseño y fabricación de soluciones, encontraba un punto débil en el proceso de obtención de los datos de entrada al diseño y posteriormente requería de grandes esfuerzos (de tiempo y dinero) para afinar la solución definitiva y por eso, nos planteamos desarrollar un software propio para solventar este problema general y habitual.
Así nace nuestro Entorno NETEOUS®, patentado mundialmente, que permite la colaboración en tiempo real entre las distintas partes implicadas en el diseño a través de internet, y facilitando desde la visualización, tanto 2D como 3D, de los modelos anatómicos, pasando por la planificación y generación de modelos, hasta la simulación de las soluciones propuestas, incluyendo todo el proceso de mejoras hasta el suministro de los materiales requeridos en cada caso.
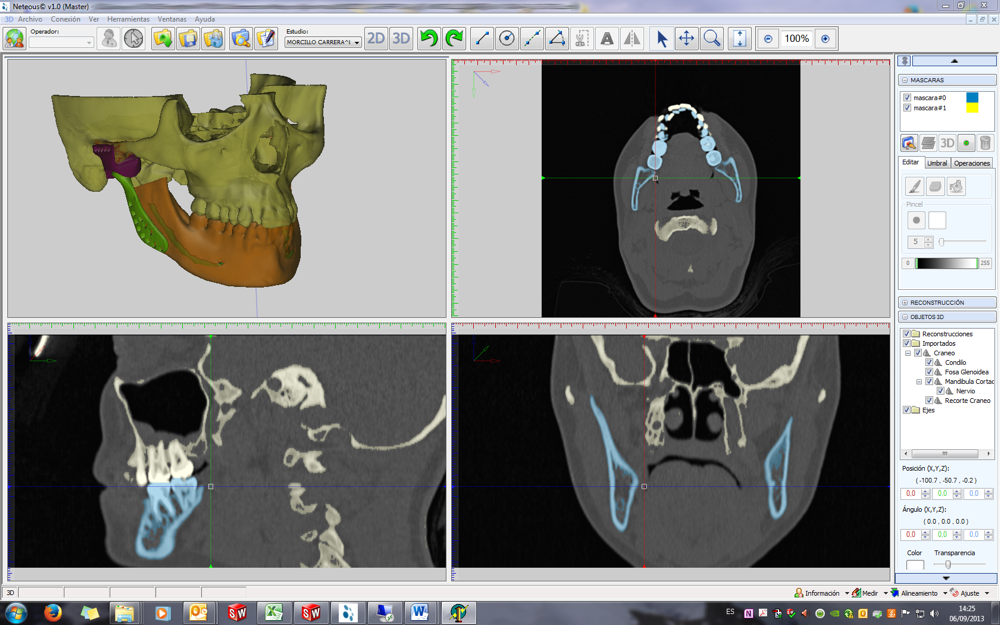

Ese entorno global denominado NETEOUS®, dispone de diferentes módulos que dan lugar a aplicaciones específicas para el abordaje de diferentes procesos, con diferentes técnicas y que hoy por hoy el mercado utiliza como herramientas diferenciadas que han ido evolucionando en base a las exigencias y posibilidades tecnológicas en cada caso.
Así nace nuestro Entorno NETEOUS®, patentado mundialmente, que permite la colaboración en tiempo real entre las distintas partes implicadas en el diseño a través de internet […]
Hoy en día, casi sin darnos cuenta, se emplean las diferentes ramas de NETEOUS®, tanto para la Ingeniería, como para la Docencia o para la Investigación.
- NETEOUS®. Componentes. Aplicaciones
Si bien definimos NETEOUS® como un sistema GLOBAL, para entender mejor su alcance y funcionamiento, hemos de abordar su descripción desde dos perspectivas diferentes. Por un lado, tendríamos lo que denominamos COMPONENTES (módulos que lo integran), tales como:
- Módulo de carga de casos: se encarga de la lectura de los archivos DICOM procedentes del escáner, en sus diferentes modalidades ya sea TAC, RM, radiografía digital, etc. Se importa a un formato propio para dotar de mayor seguridad a la información recuperada y reducir el volumen de datos a transferir mediante el uso de compresión sin pérdida. El formato DICOM es un estándar muy flexible para el almacenamiento de imágenes, que permite almacenar multitud de información, ya sea imagen, vídeo, datos del paciente, o cualquier otro tipo de información adicional, y del mismo modo permite que esta información se pueda guardar con múltiples configuraciones en compresión, formato de imagen, etc. Pese a esto, lo habitual en el uso clínico es que se utilice una configuración básica para la generación de los archivos DICOM, sin incluir en la mayoría de los casos formatos que utilicen compresión de la información [5].
- Módulo de visualización: nos permite la reconstrucción de los cortes axiales procedentes de los archivos DICOM, consiguiendo una representación de las proyecciones coronal y sagital en 2D. Del mismo modo, y gracias a los avances en hardware gráfico para el uso doméstico, nos permite visualizar en tiempo real la reconstrucción tridimensional de las estructuras anatómicas. Todo ello sin requerir de una estación gráfica ni equipamiento especializado.
-
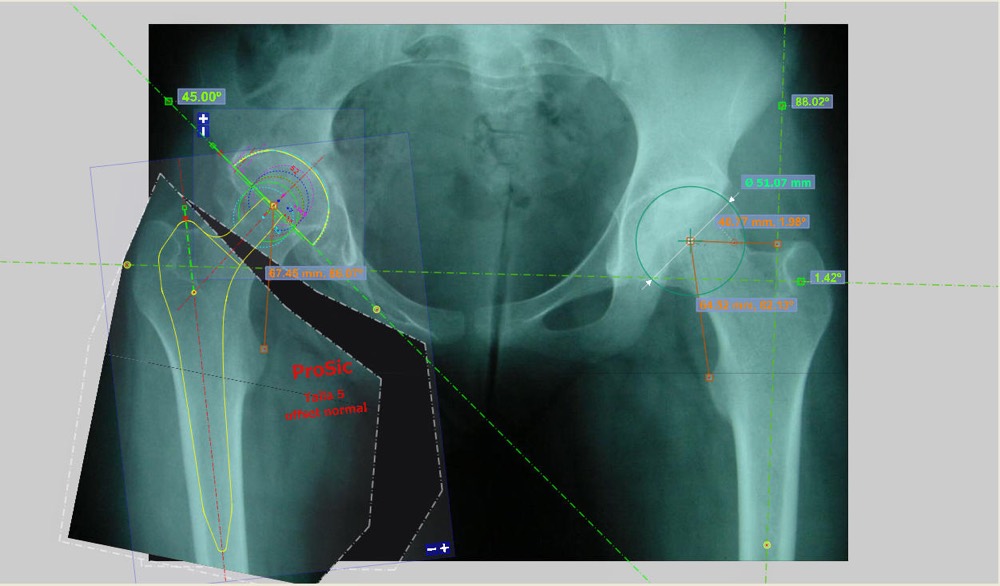
Módulo de medición: una vez podemos acceder a la información gráfica se pueden implementar todo tipo de herramientas que nos faciliten el acceso a la información representada en pantalla. Una de las principales necesidades en este sentido es la capacidad de poder establecer con exactitud las dimensiones de las diferentes estructuras anatómicas, así como las distancias y ángulos entre las mismas. Para ello se implementan distintas herramientas de medida que nos simplifican esta tarea, y que dependiendo de la anatomía en cuestión pueden ser más o menos complejas.
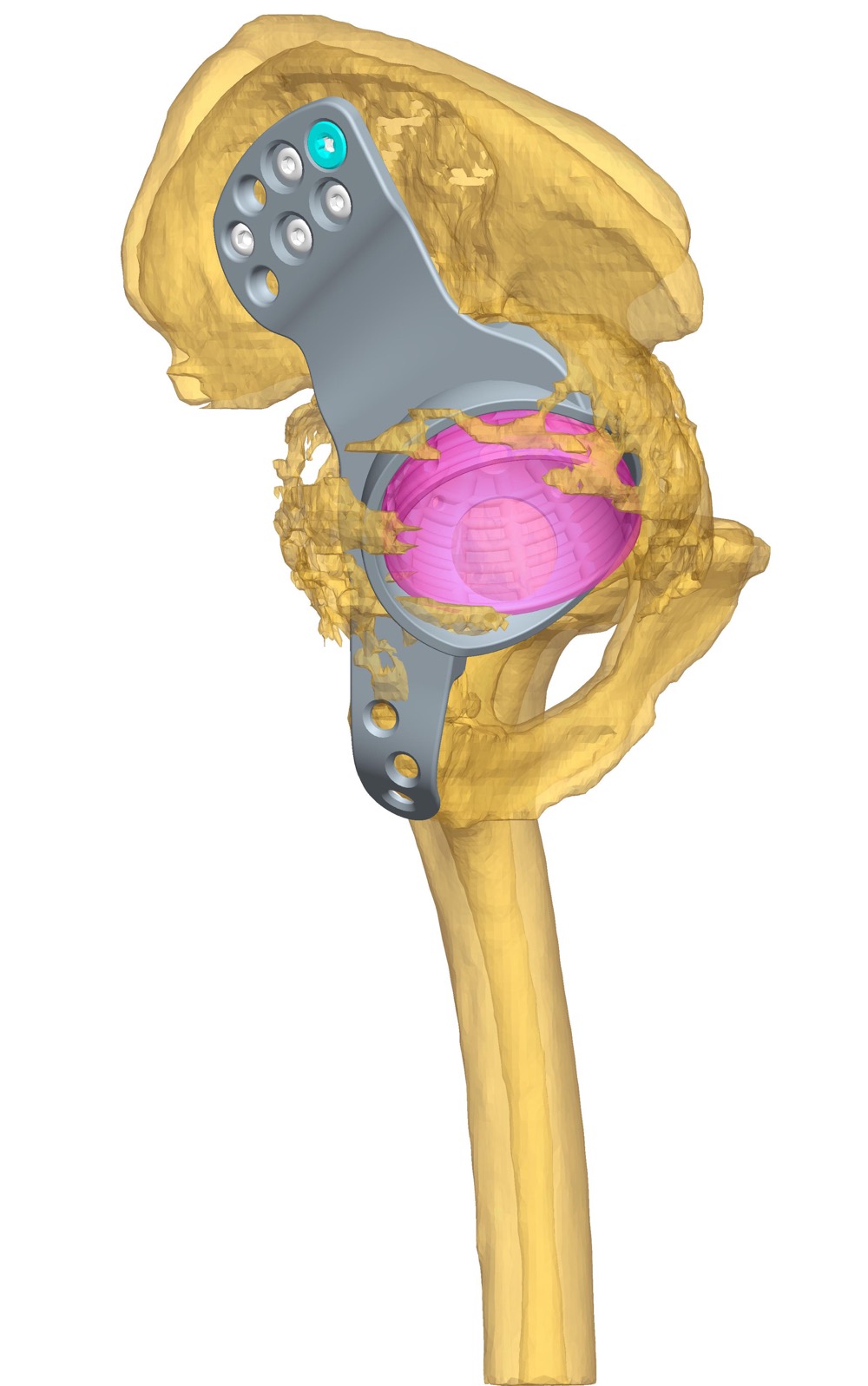
Módulo de segmentación: la segmentación de las estructuras anatómicas es el proceso por el cual definimos las zonas de interés sobre las estructuras anatómicas. Esto nos permitirá generar los modelos 3D de estas zonas, que serán la base para el diseño de implantes o elementos protésicos.
- Módulo de simulación: una vez realizados los diseños se introducen en el entorno 3D virtual para de este modo poder verificar el resultado del diseño sobre las estructuras anatómicas del paciente, pudiendo ajustar su posición y verificar posibles interferencias. Este proceso implica la intervención del prescriptor, quien introduce el criterio clínico imprescindible a la hora de dar por bueno el diseño implementado.
- Módulo de seguimiento: es de gran importancia, tanto para el prescriptor como para la ingeniería que desarrolla la solución, el realizar un correcto seguimiento del tratamiento, y por ello se implementa un módulo que nos permite recopilar toda la información desde el pre hasta el post-operatorio, personalizado para cada tipo de patología.
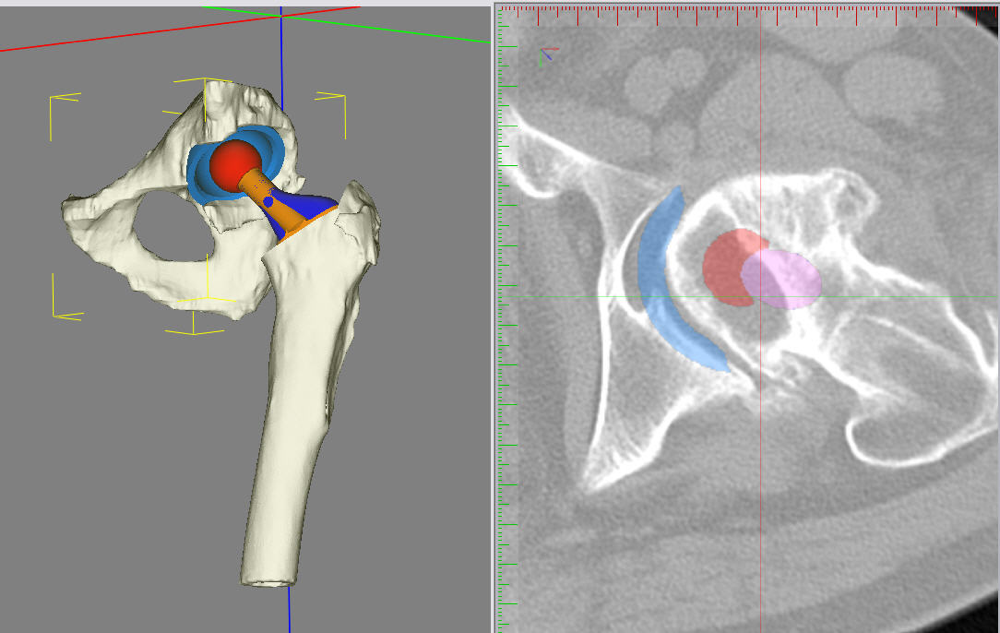
Cada uno de estos módulos es capaz de aportar las funcionalidades descritas, pero donde realmente cobran valor estos componentes es cuando debidamente mezclados, nos permiten generar una utilidad requerida por el usuario. Esto, en la práctica, se concreta en una visualización detalladas de la estructura ósea del paciente, la posibilidad de planificar la cirugía de manera virtual, generar informes útiles sobre esta planificación, poder realizar un seguimiento de casos, generar información para artículos y estudios, abordar casos complejos impensables sin esta tecnología y utilizarlo como punto de partida para el desarrollo de implantes a medida, entre otras.
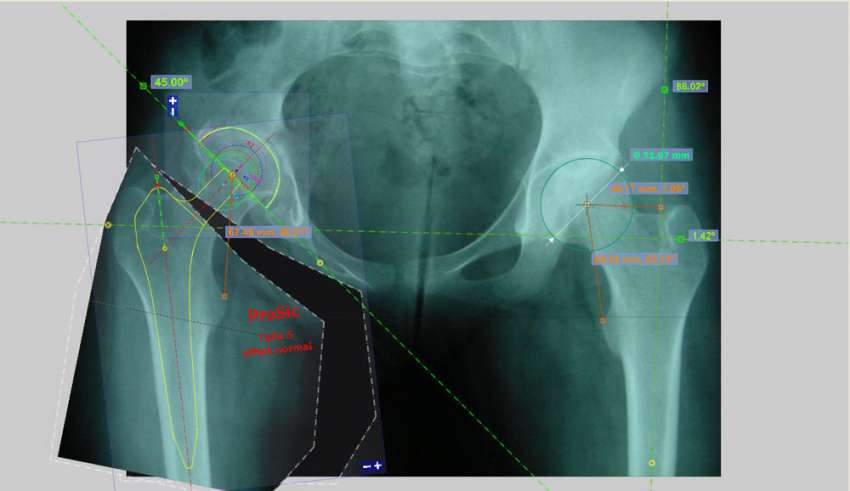
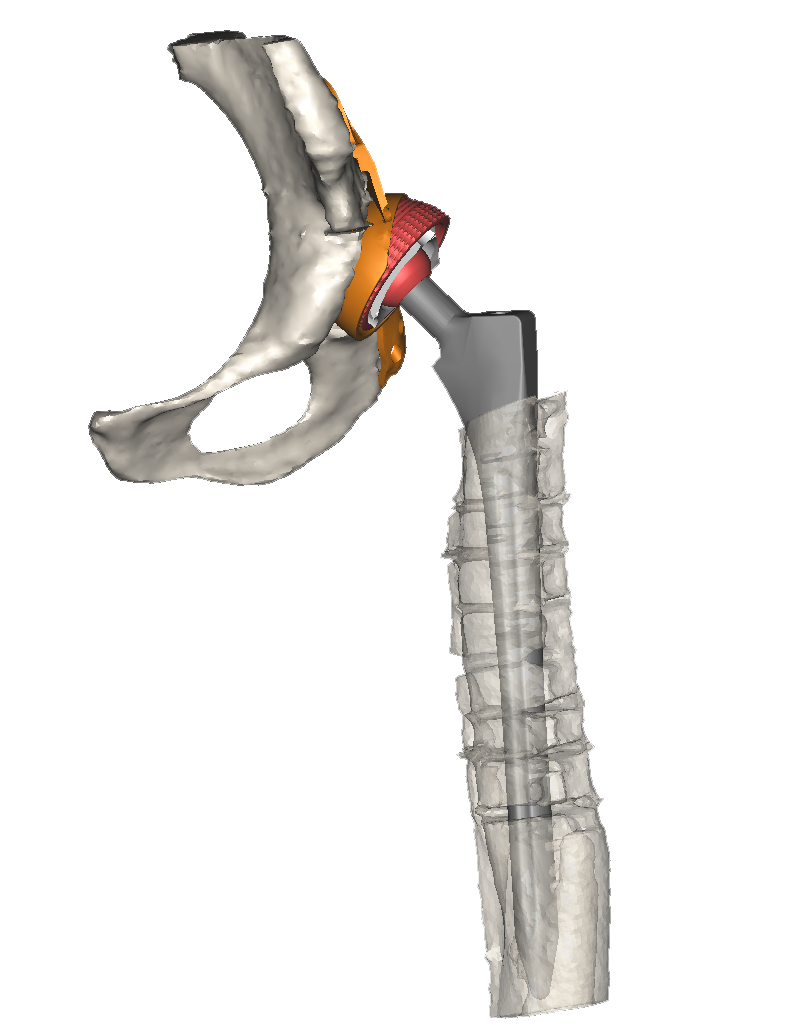
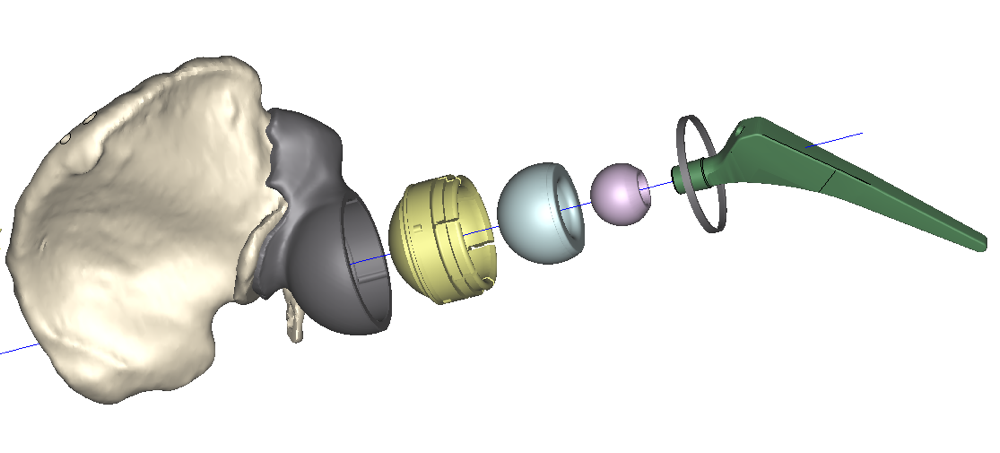
Por tanto, si nos atenemos a las utilidades (aplicaciones), disponemos de soluciones para la cirugía de cadera [2], incluyendo desde la planificación de las cirugías protésicas tanto de fémur como de pelvis en 2D y 3D, pasando por la simulación estática y dinámica del funcionamiento de la prótesis frente a la cadera anatómica.
Igualmente, hemos desarrollado aplicaciones para la Cirugía de Pie, que permiten planificar las osteotomías de corrección más habituales, el diseño de plantillas quirúrgicas y la simulación del resultado de la cirugía.
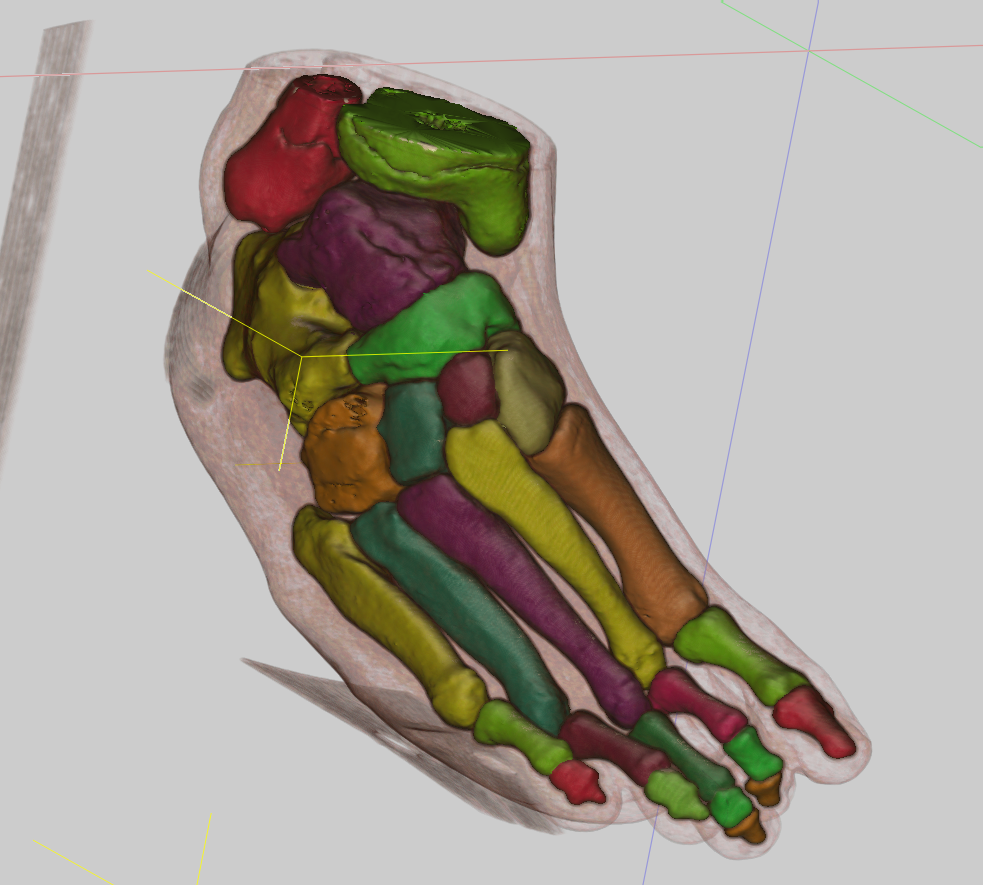
El método de planificación es sencillo. Es fundamental hacerlo con rigor para la optimización de los resultados de la cirugía. Además permite la selección del tamaño adecuado de componentes, disminuye el riesgo de fracturas periprotésicas intraoperatorias y facilita que el cirujano disponga de los componentes a utilizar, minimizando los costes del inventario.
-
- Software personalizado
Las necesidades específicas de planificación en cada patología dan lugar a la extensión de los módulos de planificación existentes, de forma que dichos módulos tomen entidad propia y se puedan ofrecer como soluciones autónomas para la resolución de problemas concretos de forma más eficiente. La función de este tipo de software se centra en la automatización de los procesos de planificación, que en muchos casos requieren de la intervención de un ingeniero para la realización y adaptación de modelos 3D, y la utilización de diferentes herramientas CAD, de forma que con una única herramienta cualquier persona con unos mínimos conocimientos pueda realizar el proceso de planificación, produciéndose un importante ahorro en los costes asociados al diseño de la solución.
-
- Implantes personalizados
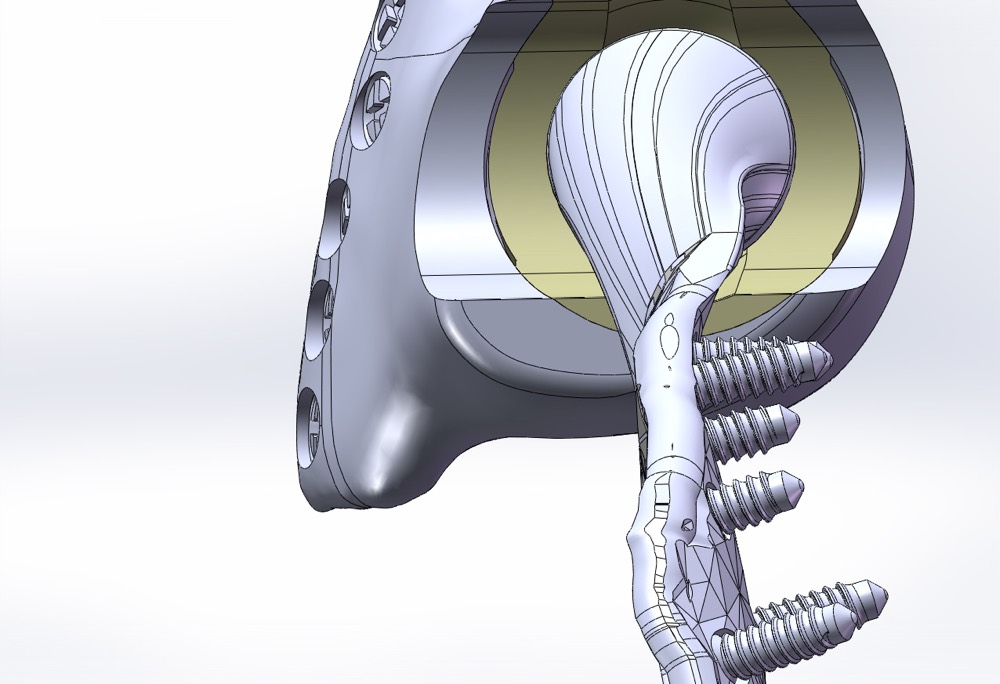
Al igual que en muchos ámbitos de la economía, donde la personalización de los productos de consumo está adquiriendo cada vez un papel más importante, el desarrollo de herramientas que permitan la personalización de los implantes es una tendencía al alza, y no por un gusto estético o por diferenciarse del resto, sino porque dicha personalización implica un beneficio directo para el paciente.
Tradicionalmente los implantes se fabrican en serie, disponiendo de un rango de tallas que se adaptan en lo posible al paciente, y aunque esto introduce un factor de error, que dependiendo del tipo de prótesis puede ser más o menos relevante, se entiende como un mal menor porque se consigue una solución a un coste más bajo para el paciente. Con los implantes personalizados reducimos el error a la hora de recuperar la funcionalidad entre el implante y la anatomía original, consiguiendo aproximarnos al sustituto o tratamiento ideal.
Con los implantes personalizados reducimos el error a la hora de recuperar la funcionalidad entre el implante y la anatomía original, consiguiendo aproximarnos al sustituto o tratamiento ideal
La personalización de implantes es algo relativamente reciente, y su evolución ha sido posible gracias a evoluciones tecnológicas como el aumento de la capacidad de procesamiento de los equipos informáticos, la digitalización de la imagen médica, y el auge de tecnologías de fabricación aditiva (Impresión 3D) [4]. Todos estos avances han hecho posible el desarrollo de herramientas software, como las mencionadas en los apartados anteriores, que permiten el diseño de soluciones personalizadas con unos costes razonables, y por lo tanto que cada vez más se introduzcan en el mercado como una opción más para el prescriptor.
Se podría pensar que la personalización se reduce solamente al campo de los implantes y prótesis, pero nada más lejos de la realidad. La personalización puede aplicarse también al instrumental utilizado en las cirugías, a realización de férulas, plantillas, o guías, que permiten mejorar los resultados de la cirugía incluso utilizando implantes tradicionales.
-
- Impresión 3D
Cabe destacar la relevancia que ha tenido la evolución de la tecnología de fabricación aditiva en el uso de soluciones personalizadas, ya que esta tecnología nos permite la fabricación de los diseños cualquiera que sea su forma y en prácticamente cualquier material, permitiéndonos adaptar cualquier diseño a la anatomía particular del paciente a costes cada vez menores.
Cada vez es mayor el número de ámbitos en los que esta tecnología está presente y es indudable que en un futuro impulsará la adopción de las soluciones personalizadas como un estándar de aplicación en el ámbito sanitario, como ya lo está siendo en otros sectores como el aeronáutico o la industria del automóvil, permitiendo diseños que de otra forma sería imposible de conseguir.

-
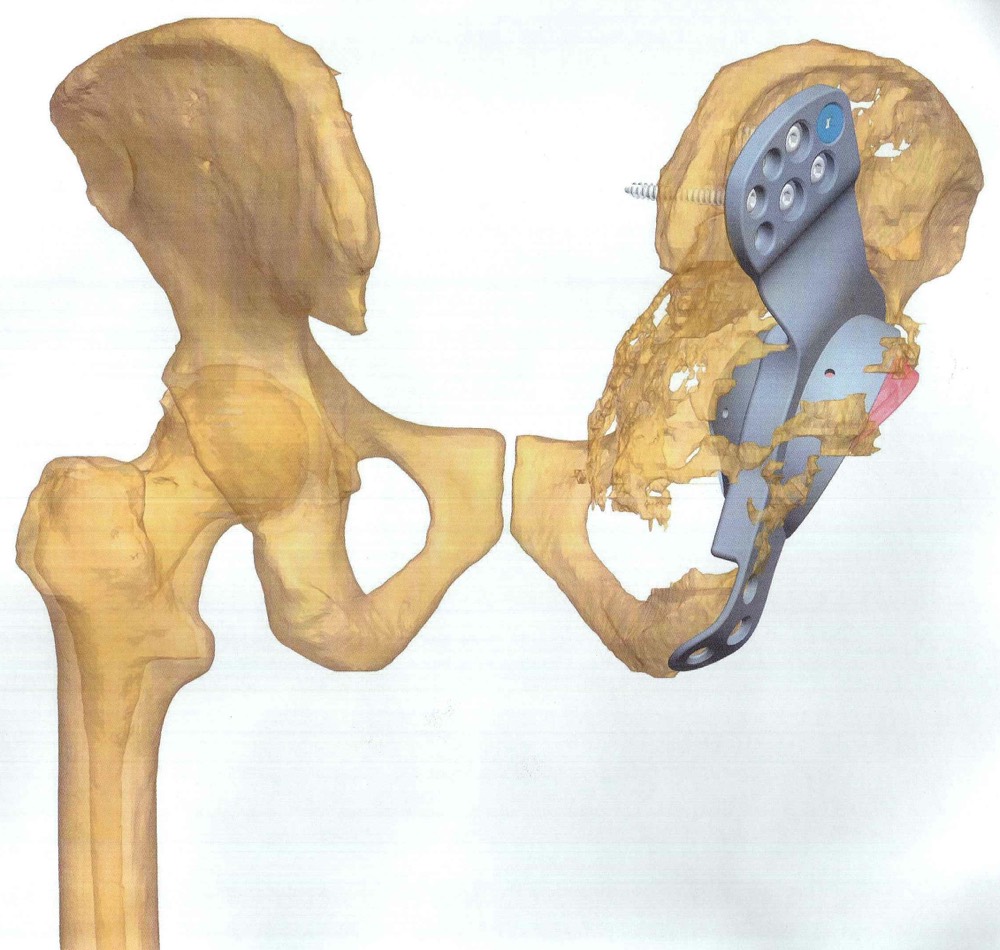
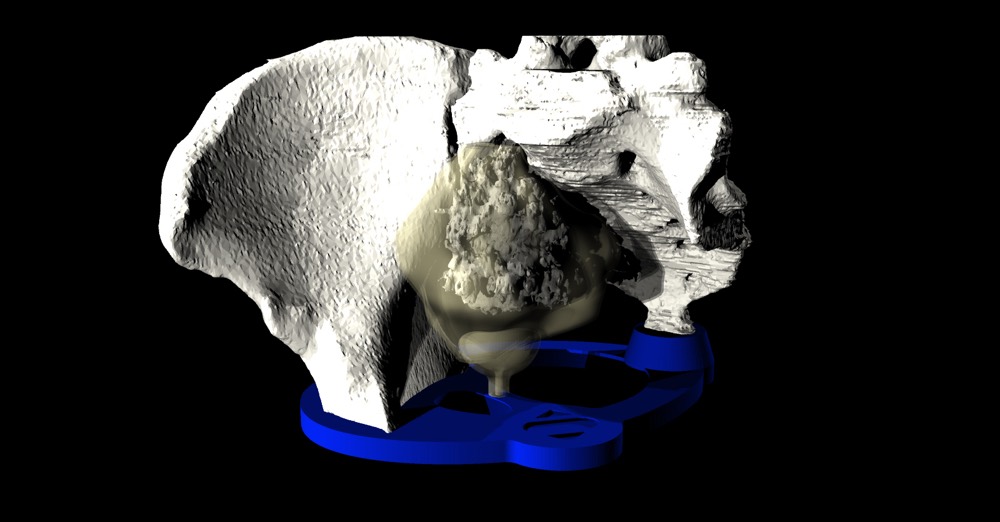
- Proceso de análisis, diseño y fabricación de un implante personalizado
Ya no se usan las radiografías convencionales por sus errores de magnificación (habitualmente de un 15-20%) que no pueden ser unificadas, al contrario que la planificación preoperatoria digital que sí lo permite y, por lo tanto, puede protocolizarse.
Los datos de las radiografía en formato DICOM se incorporan en NETEOUS®. Se visualiza la estructura ósea y la patología a tratar, tanto en 2D como en 3D. Siguiendo el criterio médico se plantean los requerimientos generales que ha de cumplir el implante. El departamento de I+D+i de Socinser diseñan el implante según estas indicaciones. Si es necesario para el estudio del caso, se administra al cirujano en un plazo mínimo un prototipo a escala real en resina del hueso y la estructura ósea a tratar.
En una segunda fase se planifica y simula virtualmente la cirugía con el implante diseñado, para su aprobación por el equipo del cirujano antes de la fabricación. Se analiza técnicamente y se produce el control de calidad tanto del implante como de las guías quirúrgicas e instrumental.
-
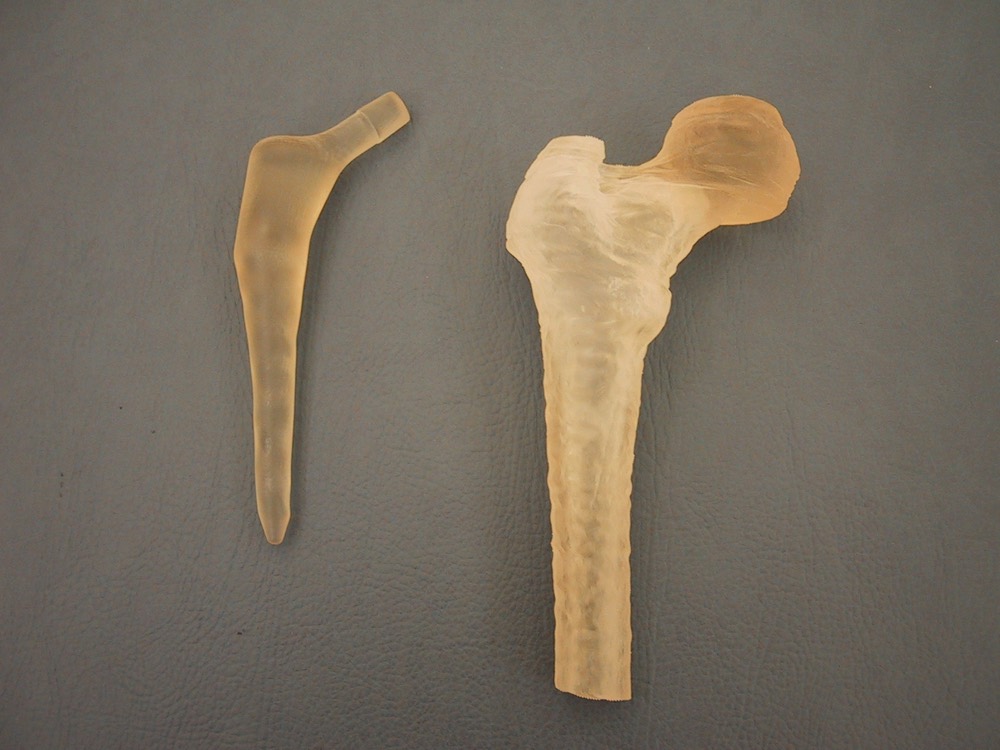
- 6. Proceso de obtención de una prótesis de rodilla personalizada
Para entender bien cómo el Software ayuda a evolucionar continuamente y a generar avances en los procesos de cirugía protésica, conviene recordar que este tipo de procesos se llevaba realizando en los últimos 30 años como un proceso artesanal, que apoyándose en las habilidades y experiencias de los cirujanos, lograba un grado de recuperación excelente en un altísimo porcentaje de casos. No obstante las exigencias del “Anciano Joven”, han conllevado que además de eliminar el dolor cada día que pasa, se espera que las prótesis duren más y que soporten exigencias mecánicas más altas, convirtiéndose dichas expectativas en un reto continuo para el cirujano y para la industria que diseña y fabrica los implantes protésicos.
Por todo los motivos antes citados, estamos asistiendo a un proceso de personalización en la cirugía protésica, que si bien inicialmente ha estado precedido por el desarrollo de herramientas informáticas para ayudar a la planificación de las cirugías, dio rápidamente paso a la posibilidad de que la industria convirtiese la planificación en un servicio de instrumentales personalizados que permitían colocar las Prótesis de Catálogo, de una forma más rápida y segura. Esta etapa denominada de instrumentales personalizados, invito a Socinser a plantear a sus clientes un paso más allá en el reto de la personalización, intentando que la propia prótesis fuese personalizada y en consecuencia, que el diseño de cada implante fuese el idóneo para cada paciente.
Así iniciamos en el año 2011, un venturoso proyecto que buscaba, además de la mejora de los tiempos quirúrgicos, el acortamiento de los plazos de rehabilitación de los pacientes y la longevidad de los implantes, para lo cual se diseño un sistema de trabajo que de forma resumida exponemos a continuación:
- Primera etapa: estudio de parámetros anatómicos del paciente. En el caso de la rodilla, hay una serie de datos geométricos que por sí mismos son capaces de revelar algunos de los trastornos de la rodilla de cada paciente. Esos datos obtenidos a través del software de análisis de imagen, de un modo tridimensional, nos permiten definir y concretar los parámetros “anatómicos”, más importantes que afectan al diseño del implante.
- Segunda etapa: elección del modelo de implante. Los diferentes tipos de implante que hay en el mercado, su utilización en diversos casos y los resultados de seguimiento de cada uno de ellos, han permitido que el cirujano pueda elegir entre un amplio arsenal de opciones. En Socinser, esa elección queríamos que fuese abierta y universal, es decir, que nuestro método de personalización no fuese esclavo de un sistema, sino que estuviese a disposición de cualquier modelo del mercado.
- Tercera etapa: ajuste del modelo. Una vez elegido el modelo de articulación que se pretende utilizar, se trabaja con los datos dimensionales y de diseño de dicho modelo, que combinado con los datos de medidas anatómicas, permiten cerrar el primer paso del diseño personalizado y sobre el cual se planteará la cirugía a realizar. Los programas que manejan los algoritmos de ajuste del modelo, se basan en una buena gestión del “Diseño Paramétrico”, que en pocos minutos nos acercan a la solución idónea.
- Cuarta etapa: definición de los planos de corte. Elegir los planos de corte óptimos, se convierte en el objetivo inmediato, para lo cual hay que manejar una serie de restricciones, que comprometen el mínimo corte óseo, un buen balance ligamentoso y una corrección de los planos de la marcha y de la alineación de la carga mecánica, que garanticen que la rodilla protésica, corrija en la medida de lo posible las alteraciones que presentaba la rodilla defectuosa. Al igual que en el caso anterior, un sofisticado sistema de manejo de diferentes combinaciones, con unas valoraciones de partida sobre las prioridades de cada exigencia, hacen que el conjunto de soluciones converja hacia un reducido grupo de opciones, que en algunos casos son propuestas para que el cirujano ayude de nuevo en la toma de decisiones final.
- Quinta etapa: diseño definitivo. En esta etapa se procede a la integración de las etapas anteriores, combinada con detalles específicos sobre el caso, que dan pie a una fase de uso del software de simulación por parte de Socinser y validación final del diseño dentro de nuestro entorno web, por parte del cirujano.
- Sexta etapa: fabricación y servicio. Una vez cerrado el diseño en la etapa anterior, se está ante una fase de pura industrialización, que permite generar una solución, que aporta por un lado, los implantes personalizados y por otro, lado los instrumentales de guiado quirúrgico para llevar a cabo esa personalización.
4. Conclusiones
Las aplicaciones informáticas que procesan imágenes digitales de los pacientes, han permitido dar un importante cambio en el reparto de tareas de las organizaciones médicas y asistenciales, dando paso a un proceso de adaptación y sobre todo, de evolución de los métodos quirúrgicos, llegando a girar de una forma clara alrededor de la problemática singular de cada paciente.
Las aplicaciones informáticas que procesan imágenes digitales de los pacientes, han permitido dar un importante cambio en el reparto de tareas de las organizaciones médicas y asistenciales […]
El balance entre planificación quirúrgica previa realizada en base a aplicaciones informáticas y la ejecución del proceso quirúrgico previamente planificado con estas herramientas, han dado pie al diseño de componentes (implantes e instrumentales) adaptados a cada paciente y en consecuencia se ha potenciado la cirugía mínimamente invasiva, logrando reducir los procesos de recuperación postquirúrgica e incrementando la eficacia de las soluciones.
Referencias
[1] AENOR. “Software de dispositivos médicos. Procesos del ciclo de vida del software. (IEC 62304:2006)”. 28 de marzo de 2007. <http://www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0038684>. Último acceso: 16 de Agosto de 2017.
[2] Gallart X, J. J. Daccach, J. A. Fernández-Valencia, S. García, G. Bori, J. Rios y J. Riba. “Estudio de la concordancia de un sistema de planificación preoperatoria digital en artroplastia total de cadera”. Revista Española de Cirugía Ortopédica y Traumatología, Vol. 56, Issue 6, 2012. <http://dx.doi.org/10.1016/j.recot.2012.08.003>. Último acceso: 16 de Agosto de 2017.
[3] J. A. González. “Procesos y aspectos clave en el sector de los productos sanitarios”. Revista Calidad. Asociación Española para la Calidad. <https://www.aec.es/c/document_library/get_file?p_l_id=231893&folderId=195586&name=DLFE-10903.pdf>. Último acceso: 16 de Agosto de 2017.
[4] J. Harrop. “3d Printing 2017-2027: Technologies, Markets, Players Current usage, future applications and market forecasts”. IDTechEx. <http://www.idtechex.com/research/reports/3d-printing-2017-2027-technologies-markets-players-000501.asp>. Último acceso: 16 de Agosto de 2017.
[5] National Electrical Manufacturers Association. “Digital Imaging and Communications in Medicine (DICOM)”. 2004. <http://dicom.nema.org/dicom/2004/04_01pu.pdf>. Último acceso: 16 de Agosto de 2017.



